联系我们
- 电话/微信:18520902353
- 客服QQ:3597831168
- 邮箱:info@wemaxnano.com
- 地址:广东省佛山市南海区狮山镇塘头名创钢材仓储园B区二楼
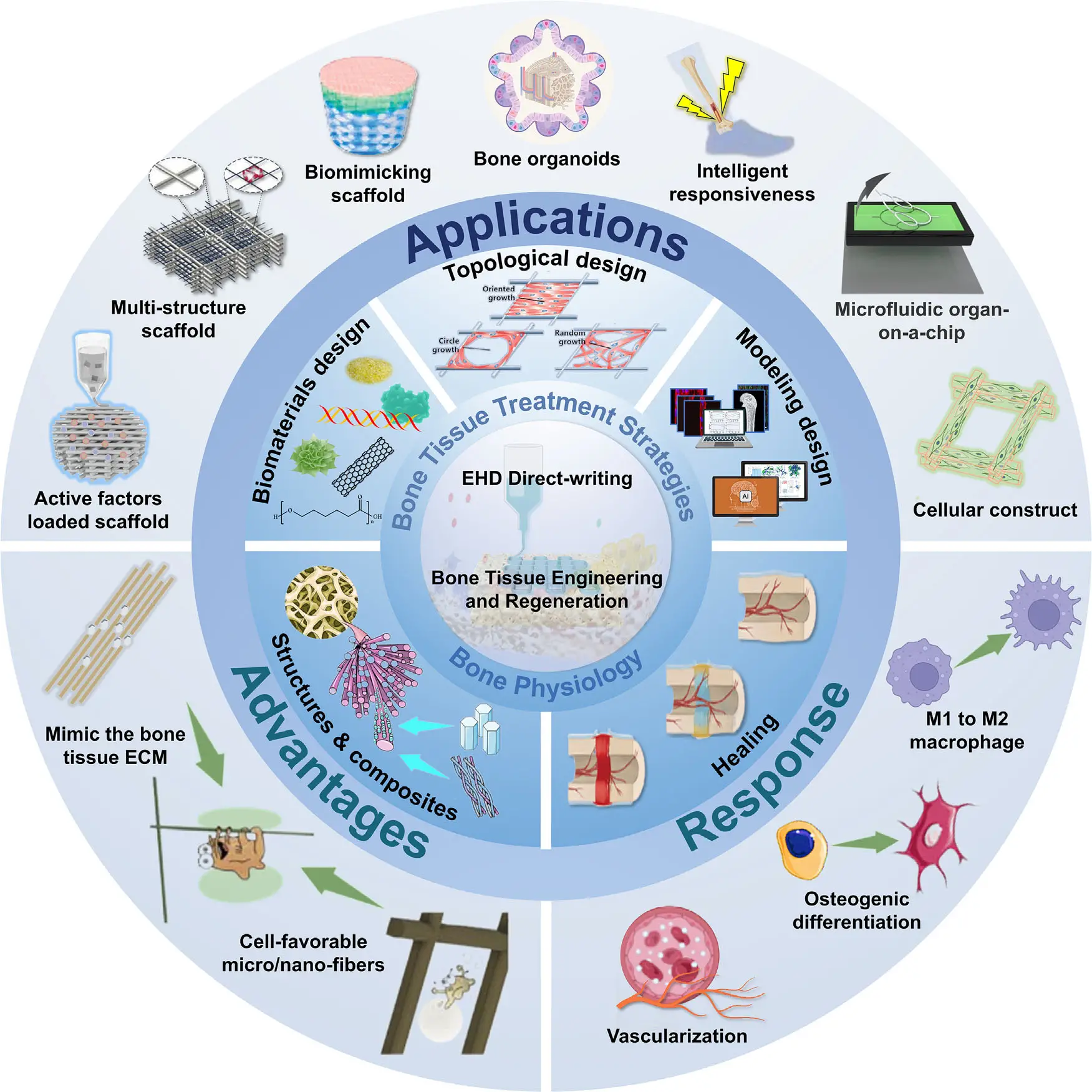
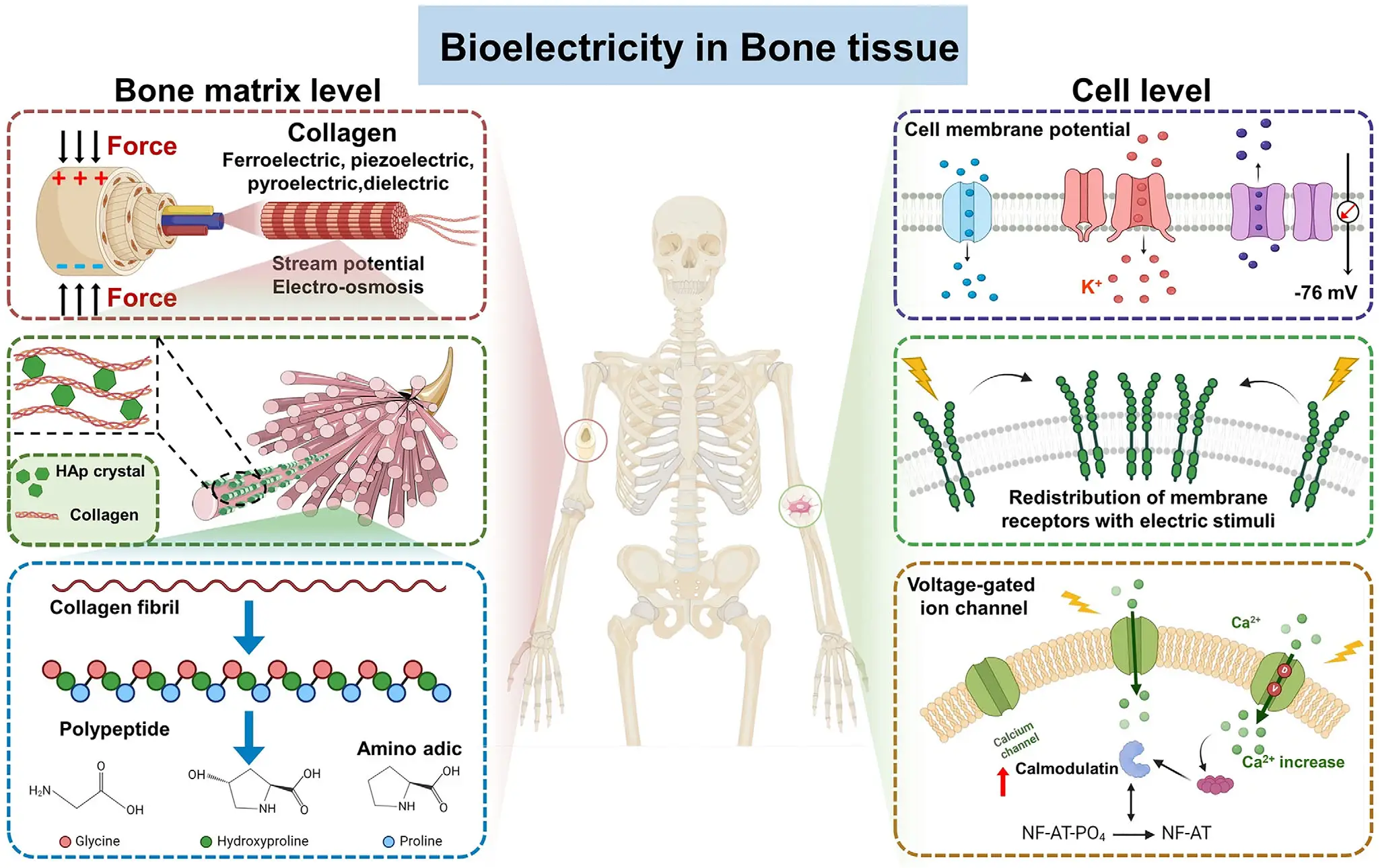
在2025年发表于 Advanced Functional Materials 的最新综述论文《Enhance Electrohydrodynamic Direct‐Writing Potential in Bone Tissue Engineering Design》中,来自太原理工大学生物医学工程系 / 纳米生物材料与再生医学研究中心 / 人工智能学院黄棣教授、张鹏飞博士等研究团队,对电流体动力直写(EHD 直写)在骨组织工程中的创新设计、跨学科融合与未来方向进行了系统总结。论文系统梳理了骨组织工程中的关键进展:在微/纳尺度精控纤维直径、孔形与取向以实现结构仿生;在打印过程中在位加载因子与细胞,驱动生物响应;并以数据与算法介入工艺,迈向智能调控与个体化制造。
本文结合该综述的系统框架与实际工程可操作性,整理出8个可直接应用于骨修复的电纺直写方案。每个方案均包括“能做什么—怎么做—用什么材料—适配什么场景—达到什么效果”,并以真实研究数据与可复现设计逻辑为支撑,供科研与产业端借鉴。

电流体动力直写(EHD直写)是一种结合电纺与精密打印的微尺度制造技术。它通过高压电场将聚合物流体从喷嘴端精准“拉丝”沉积,能在微米级范围内控制纤维的直径、间距与取向(见图3)。相比传统3D打印,EHD直写可更真实地复刻骨组织的层级结构,实现高精度成形、可编程孔隙设计与多材料共打印。它让“材料–结构–生物功能”在一个工艺中协同调控,为个体化骨修复提供了兼具科学性与可操作性的路径。
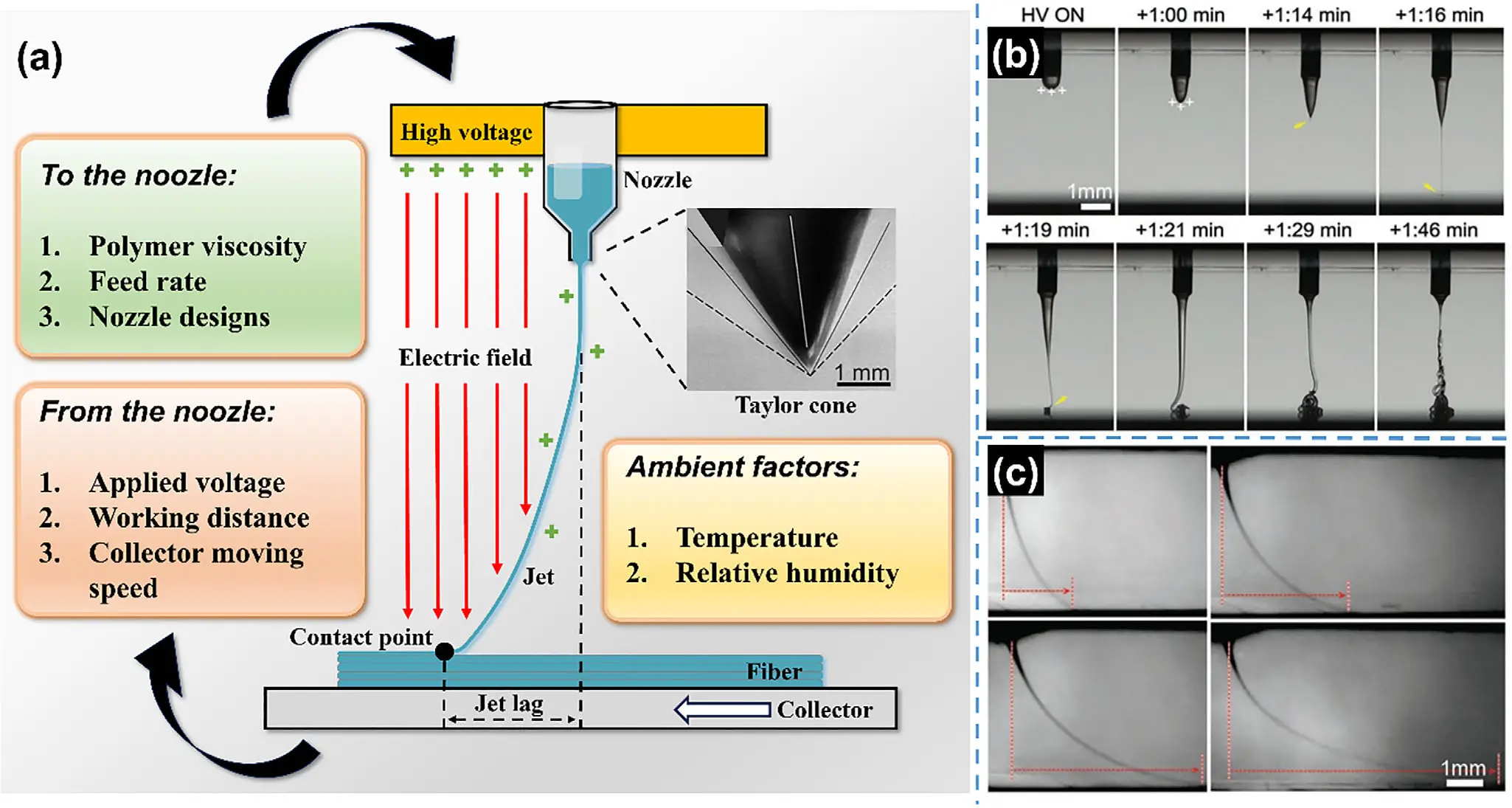
图3:EHD直写的工作原理与影响参数
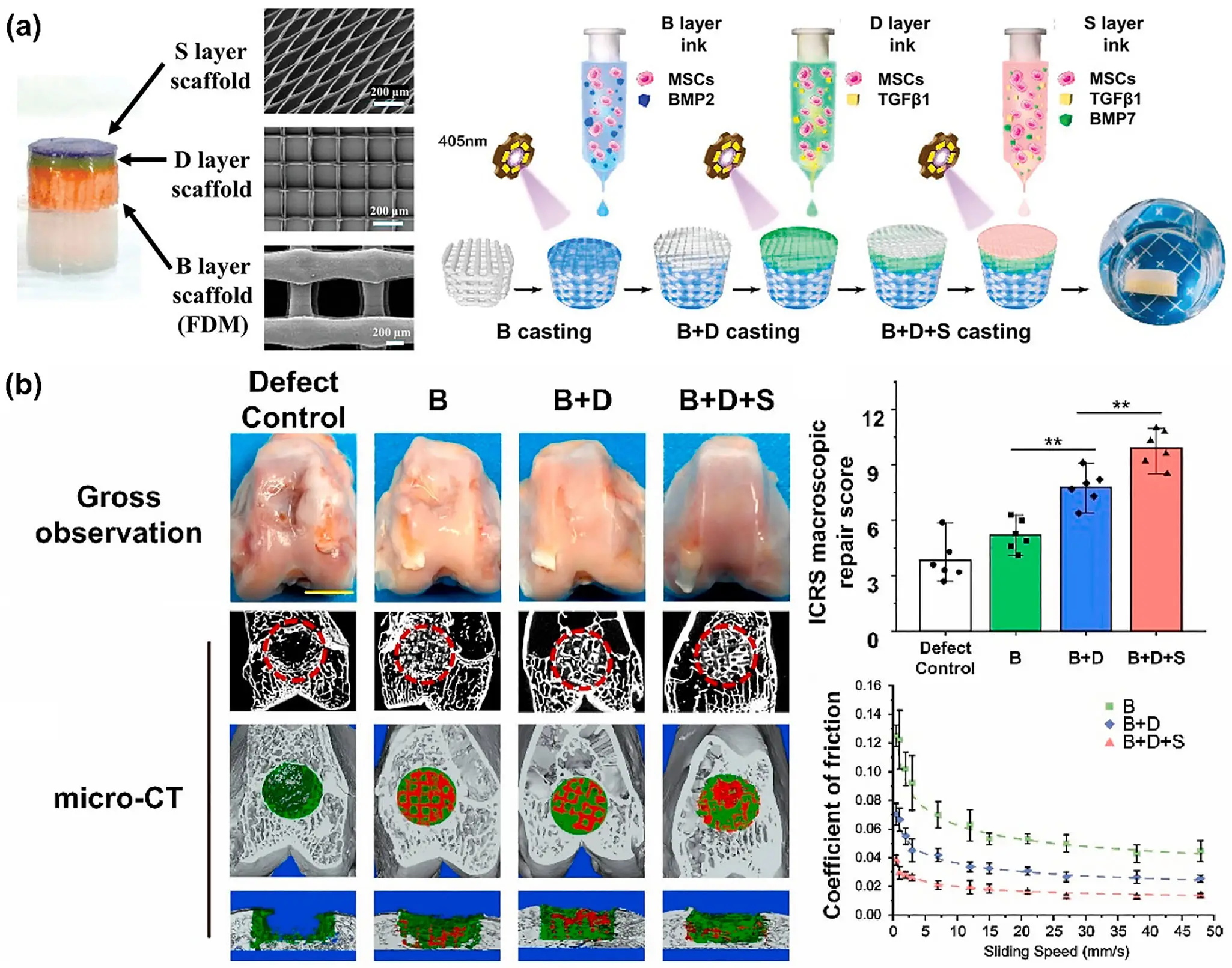
1. 思路: 通过电纺直写实现表浅软骨层、深层软骨层和亚软骨骨层的“分区结构一体化打印”。
2. 如何应用:用电纺直写(EHD 直写)把“表浅软骨/深层软骨/亚软骨骨(S/D/B)”三层直接写进支架:在同一块植入体内,按分区设置纤维直径、孔径与取向(表浅层细纤+平行取向,深层交错增强抗剪,骨端层加密并提高模量)。打印完成后,将含细胞/分区生长因子的水凝胶(如 GelMA)分别灌注到对应分区,实现结构指令+生物信号同步到位,适配关节承重区的骨-软骨复合缺损。动物实验表明,这种三层复合支架在中后期呈现出更完整的缺损填充与更接近原生组织的外观/组织学表现。
3. 材料/场景:PCEC(三嵌段 PCL-PEG-PCL)/PCL 作为骨架,GelMA 作为水凝胶;用于关节承重区骨-软骨复合缺损。
4. 效果:动物实验里,三层复合支架能更完整地填充缺损、外观更接近原生组织,相比空白对照的修复明显更好。
可以替代的材料有:
• 骨架(承力层):PCL、PCEC(PCL-PEG-PCL)、PLA、PLGA、TPU、PGA;若需导电/机电耦合,可在骨端层或过渡层少量复合 PVDF、PEDOT:PSS、碳纳米管/石墨烯。
• 促成骨填料(骨端层/过渡层掺混或涂覆):HAp、β-TCP、生物活性玻璃、镁/锌系磷酸盐微粒。
• 水凝胶(软骨向与过渡层):GelMA(常用)、PEGDA、海藻酸盐(可与Ca²⁺交联)、透明质酸衍生物、明胶/胶原、丝素蛋白、壳聚糖等;需要更高抗压时,可在凝胶中加入短纤维/纳米黏土/SiO₂微填料。
1. 思路:用EHD直写PCL格栅提供结构刚度,再灌注含细胞的GelMA凝胶提升生物性能。
2. 如何应用:先电纺直写高孔隙率PCL微纤格栅,再灌注含细胞的水凝胶(GelMA 等)形成“骨架承载 + 凝胶生物友好”的复合体;需要贴合解剖曲面时,同步动态校正喷嘴-收集距离在曲面沉积,再灌注细胞凝胶。
3. 材料/场景:PCL + GelMA;用于软骨/松质骨等对压缩性能敏感、且可能为非平面的部位。
4. 效果:复合后刚度/强度显著提升(可接近软骨区间),曲面样件在28天保持形状并形成均匀软骨样组织。
可以替代的材料:
• 骨架:PCL、PLGA、PLA、PCL-HAp/β-TCP 共混或包埋。
• 水凝胶:GelMA、海藻酸盐、胶原/透明质酸、PEGDA;可混入纳米填料(黏土、羟基磷灰石纳米晶等)以抬升模量。
• 曲面实现手段:旋转/可调距收集器、预补偿路径(G-code 曲率超前)
1. 思路: 双喷头协同打印,一路沉积PCL,一路挤出含MSCs凝胶,精准控制细胞分布。
2. 如何应用:在同一平台上同步完成两路沉积:一路熔融直写 PCL 微纤作为骨架,另一路挤出含 MSCs 的水凝胶,在同一层实现多材料/多细胞的精准定位。
3. 材料/场景:PCL + 含 MSCs 的 GelMA/海藻酸盐;适合大体积、异质分区的骨修复与快速一体化成形。
4. 效果:复合体压缩模量与模具浇注对照相当,且不影响细胞生长/分化;显著提升设计自由度与细胞布置可控性。
可以替代的材料:
• 骨架:PCL、PLGA、PLA、PCL-HAp/β-TCP。
• 凝胶:GelMA、海藻酸盐(Ca²⁺即刻交联)、胶原、透明质酸衍生物。
• 增强件:同轴中空纤维(缓释因子)、导电层(PVDF、PEDOT:PSS)用于后续电刺激。
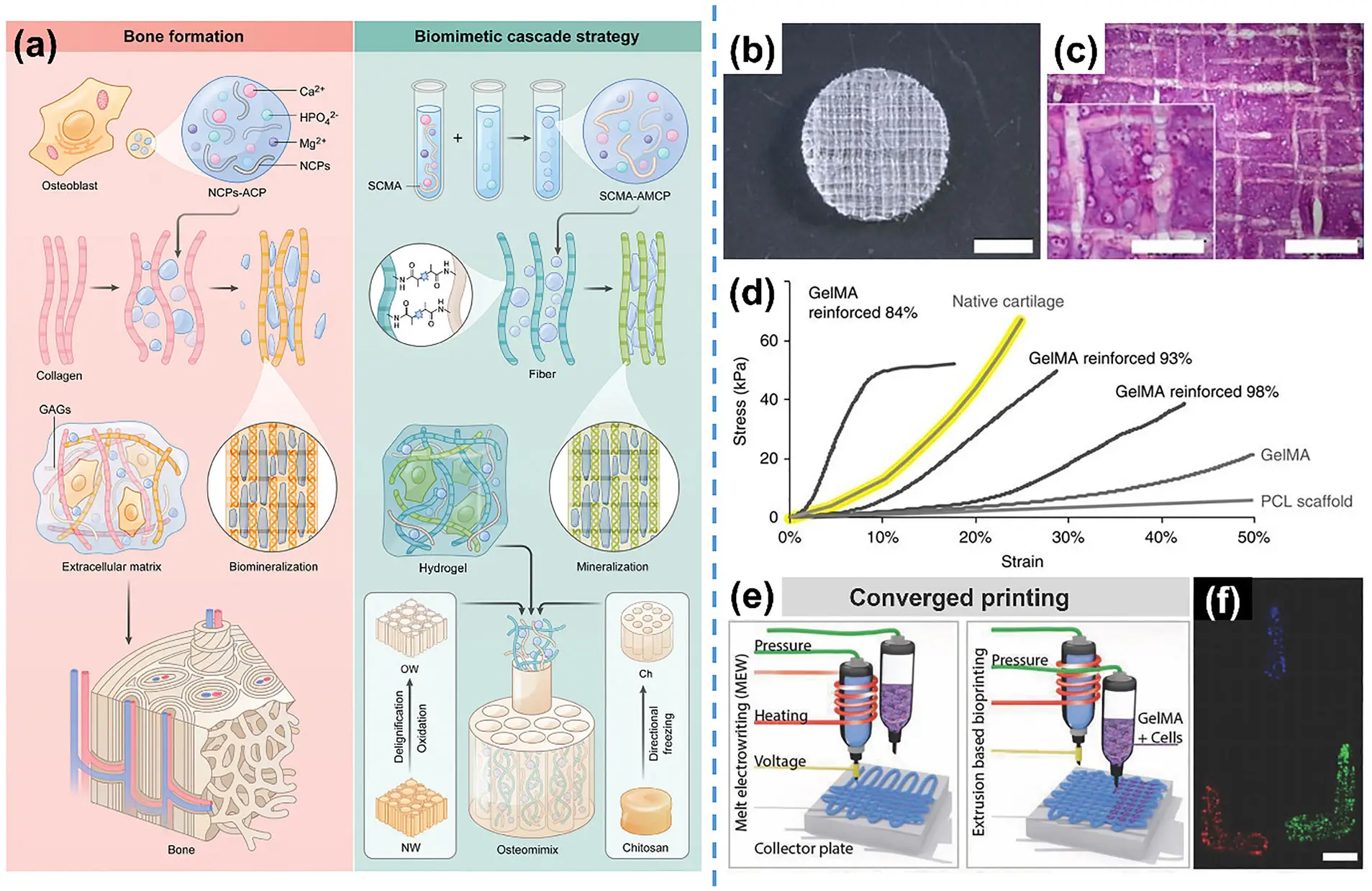
图12:双材料打印的复合增强支架
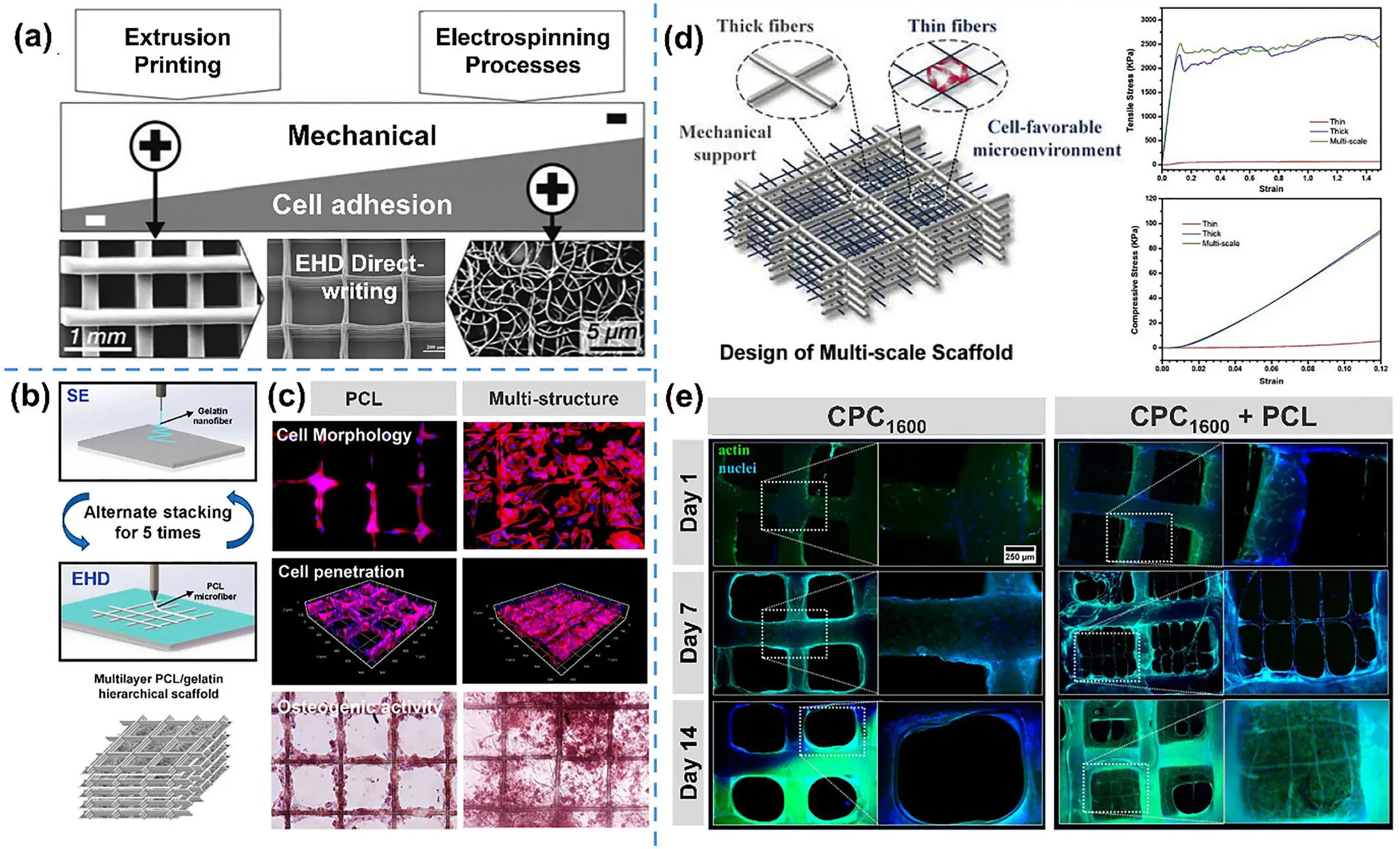
图11:同步共打印的多材料协同结构
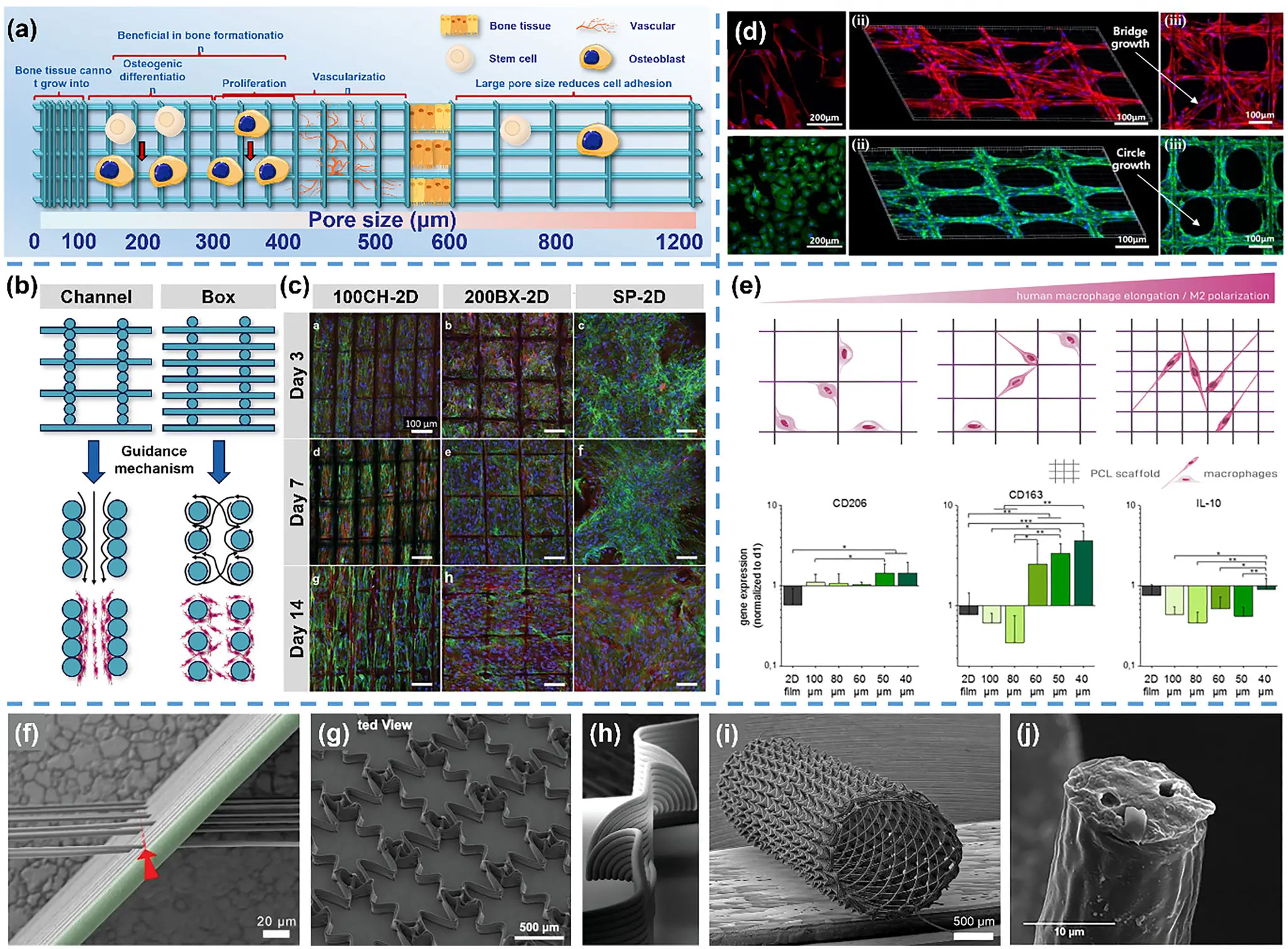
1. 思路: 通过CAD设定100–350 μm孔径与取向通道,实现细胞导向与免疫调节协同。
2. 如何应用:在 CAD 阶段设定孔径(约 100–350 μm)与纤维取向/通道形貌,电纺直写精确实现;小孔/取向通道用于早期黏附与定向迁移,较大孔利于营养/血管长入。
3. 材料/场景:PCL 或 PCL-HAp/β-TCP;适配导向修复 + 早期免疫调节并重的缺损部位。
4. 效果:200–350 μm 孔径利于成骨细胞增殖分化;较小孔径倾向促巨噬细胞向 M2(抗炎)极化;取向通道增强细胞排列/迁移,整体再生质量提升。
可以替代的材料:
• 骨架:PCL、PLGA、PLA、TPU(需一定弹性);
• 表面工程:PDA/胶原/明胶涂层、等离子体亲水化;
• 凝胶填充:GelMA、PEGDA、海藻酸盐、透明质酸衍生物(可做分区
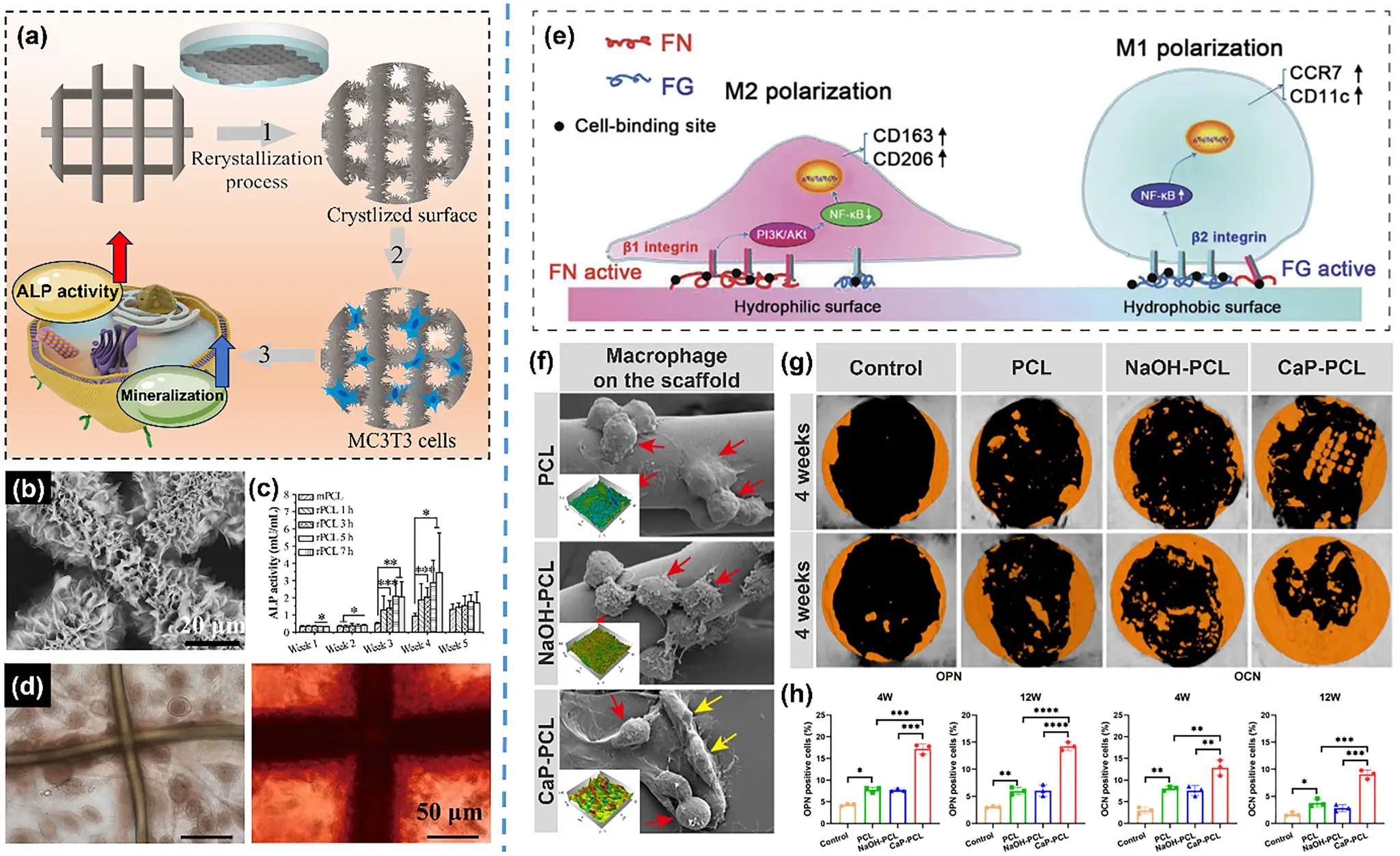
1. 思路: EHD打印后对PCL进行温和再结晶(rPCL),增强刚度与亲水性,再表面修饰ECM涂层。
2. 如何应用:电纺直写 PCL 网格后做温和再结晶(rPCL)以提高纤维结晶度和早期刚度;随后可进行亲水化或CM 悬液(如 DAT)涂覆,改善初期黏附与成骨信号。
3. 材料/场景:PCL 主体;适合“早期承载 + 成骨信号强化”的松质骨/过渡区。
4. 效果:杨氏模量从约 1.1 GPa 提升到约 2.5 GPa;ALP/钙化等生物学指标同步向好,细胞增殖不受损。
可以替代的材料:
• 骨架:PCL、PLLA、PLGA、PCL/PLGA 共混。
• 表面/涂层:PDA、胶原/明胶、RGD 肽、ECM 悬液(DAT)、等离子体处理。
• 功能填料:HAp、β-TCP、生物活性玻璃、微量 Sr²⁺/Mg²⁺ 离子源(喷涂/浸渍)。
1. 思路: 同一支架几何结构诱导不同细胞自然分区:BMSCs易桥连,HUVECs沿边成环。
2. 如何应用:先直写统一孔形的网格,然后分别接种BMSCs 与 HUVECs(或对应友好凝胶)。利用孔壁曲率/边界诱导,实现BMSCs 更易“桥连”,HUVECs 更易沿边成环的功能分工。
3. 材料/场景:PCL/PCEC 框架 +(GelMA/胶原/海藻酸盐)载体;适用于骨-血管协同(大体积缺损、骨-软骨界面)。
4. 效果:无须改变孔形即可实现两类细胞的协同分布,利于后续成骨与成血管并行推进。
可以替代的材料:
• 骨架:PCL、PCL-明胶共混、PCL-HAp。
• 凝胶:GelMA、海藻酸盐(Ca²⁺交联)、胶原、透明质酸。
• 功能添加:VEGF/Ang-1 等血管生成信号(微球/层间限域)
1. 思路: 构建跨越不塌、空心导流、倾斜承载等单元结构,实现多功能“骨支架积木”
2. 如何应用:利用电纺直写可编程性,构建悬浮交点(跨越不塌)、正弦波状纤维(缓释/力学调制)、倾斜墙体(各向异性承载)、管状/空心纤维(导流/缓释)等单元,按缺损形态组合成目标结构。
3. 材料/场景:PCL 为主,按需加入 HAp/β-TCP;同轴实现“壳-芯”结构(芯相可抽离/缓释)。适配个体化解剖形状、需要灌注/导流/缓释的病例。
4. 效果:在微米尺度上实现跨越、导向、导流、缓释等多功能结构,贴合解剖与传质需求。
可以替代的材料:
• 壳层骨架:PCL、PLGA、PLA、TPU。
• 芯相/可抽离:Alginate、PEG、水溶性聚合物(后抽离或离子交联)。
• 功能填料:HAp、β-TCP、生物活性玻璃、Mg/Zn 颗粒(可做离子缓释)。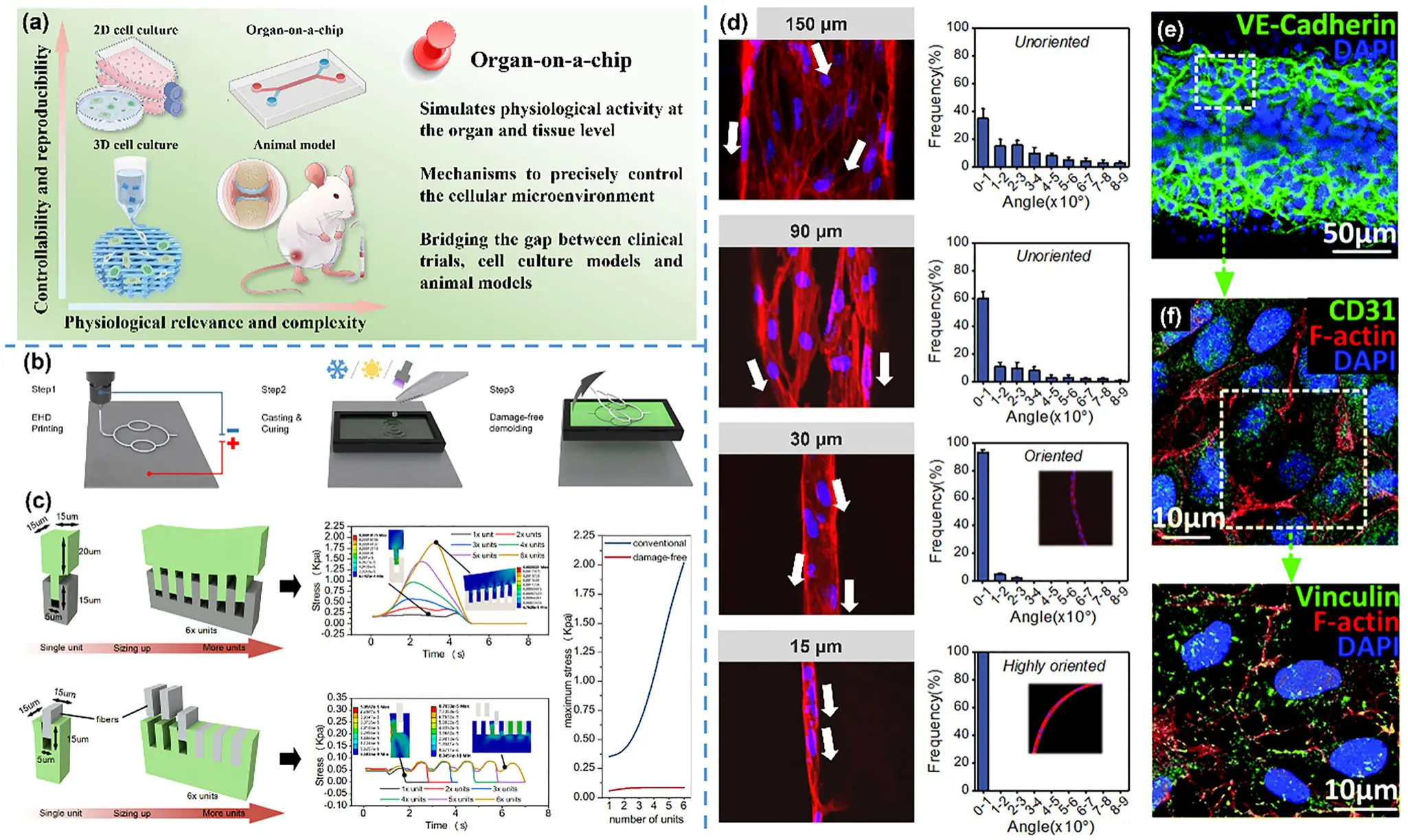
1. 思路: 通过生长仿真(弦模型)预测不同孔形的桥连速度,用EHD直写实现可验证设计。
2. 如何应用:在打印前用组织增长模型(如 common-chord/弦模型)对三角/方形/六边形/圆形等孔形进行仿真,预估桥连速度与中央开口收缩路径;据此确定孔形/尺寸/边角圆整度并直写实施。
3. 材料/场景:任何可直写的可降解骨架(PCL/PLGA/PLA 等);用于方案早期比选、快速迭代与个体化优化。
4. 效果:体外实验与仿真一致:孔角先“圆整”,再形成“跨越圆”直至桥连;不同孔形对应可预测的组织形成路径,降低试错成本。
可以替代的材料:
• 骨架:PCL、PLGA、PLA、PCL-HAp/β-TCP。
• 表面/涂层:PDA/胶原/明胶、RGD 肽段(提升早期黏附)。
• 验证用水凝胶:GelMA、海藻酸盐、PEGDA(便于对比不同孔形下的细胞/组织行为)。
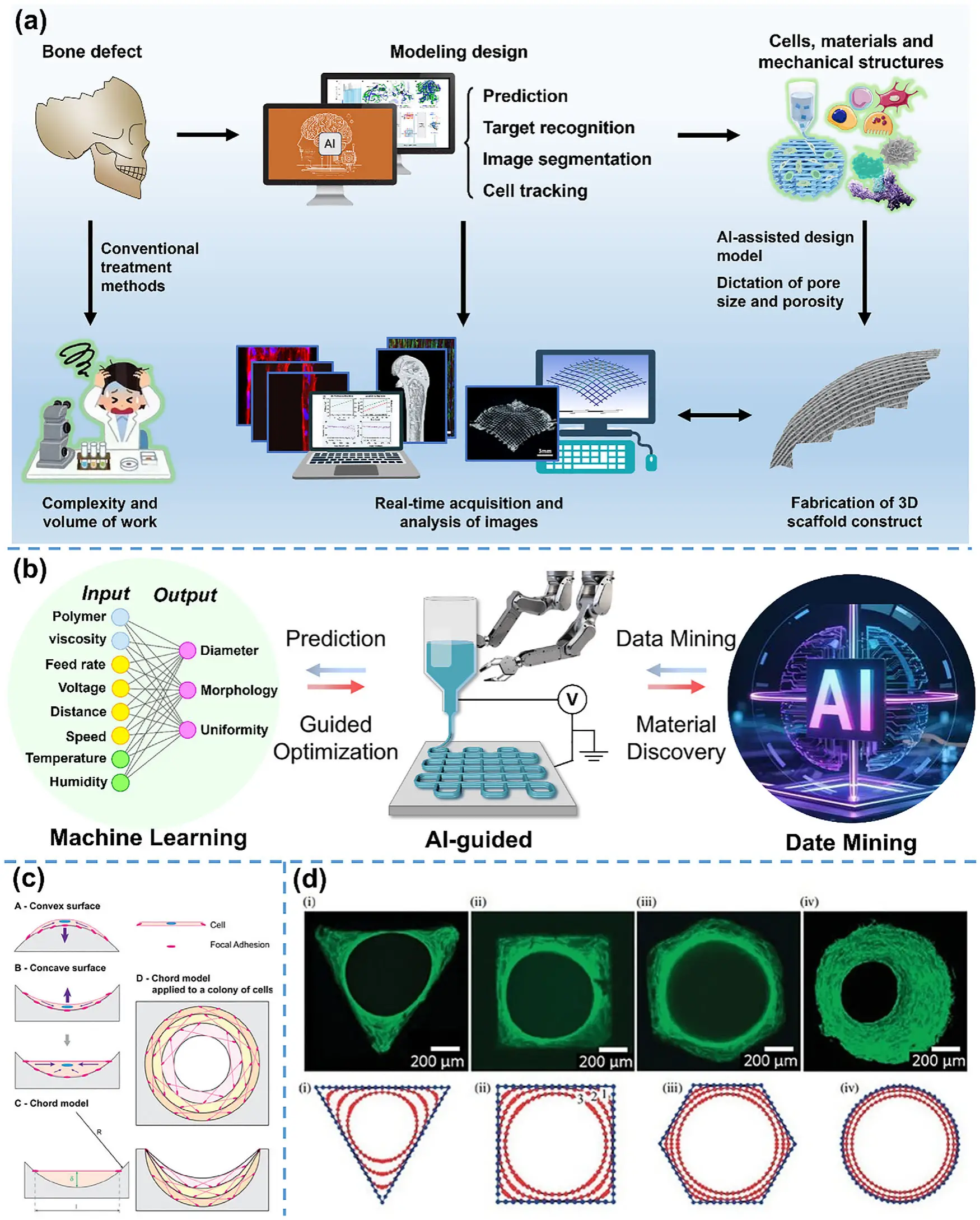
EHD直写让“骨修复支架”从概念走向可控设计——纤维的排列、孔径、材料、信号都能被精准书写。正如黄棣教授团队在 Adv. Funct. Mater. (2025) 综述中所强调的,这项技术的价值不止于制造,更在于用结构去引导再生。从8个可落地方案出发,我们看到EHD直写正在让骨组织工程进入一个可设计、可验证、可智能优化的新阶段。

论文来源:https://doi.org/10.1002/adfm.202519074

联系客服二维码

纳米纤维及其应用